Ce produit est si familier qu’il en apparaît banal et sans aucun mystère. Et pourtant ses multiples usages mettent en oeuvre des principes scientifiquesfondamentaux.
Pourquoi le sel est-il blanc?
En réalité, lorsque le sel est à la fois très pur et parfaitement cristallisé, il est totalement incolore! Un monocristal de sel est transparent: on l’obtient par lente cristallisation contrôlée. Les impuretés emprisonnées dans les cristaux de sel, à commencer par l’humidité, sont responsables de sa coloration blanche, par diffusion, réfraction et réflexions multiples de la lumière à l’intérieur des cristaux. Certaines formes de sel ont d’autres couleurs, provenant d’autres impuretés que l’eau. Par exemple, le sel gris de Guérande, qu’affectionnent les gourmets, est de teinte grisâtre, car il a cristallisé en colonnes verticales à partir du fond du marais salant, et il s’est donc contaminé de particules de divers minéraux.
Comment les mines de sel se sont-elles formées?
Le sel peut s’obtenir par évaporation à l’air libre de l’eau de mer dans des marais salants, lorsque le climat le permet, c’est-à-dire lorsque la belle saison ensoleillée n’est pas entrecoupée de pluies qui viendraient détruire la récolte. C’est l’une des plus belles utilisations de l’énergie solaire. Certaines mers (Caspienne, Mer Morte, Grand Lac Salé) ont de fortes salinités, car l’évaporation l’emporte sur l’apport par les rivières et fleuves des sels minéraux lessivés des sols par les pluies. À l’extrême, lorsqu’une mer a ainsi disparu, il ne reste plus à sa place qu’une évaporite de sel. Lors des temps géologiques, petit à petit, les couches de sel d’évaporites marines (premier stade) furent écrasées par des sédiments plus denses (second stade). Aussi, on assiste ensuite au cours des temps géologiques à une remontée du sel par les fissures de l’écorce terrestre, un peu comme de la crème venant surnager sur du lait. Ce mouvement d’un minéral, un solide dur et rigide pourtant, est un écoulement lent du sel. Il s’effectue, à l’échelle microscopique, par glissement des plans contenant les atomes, le long des lignes de dislocation du cristal. Se forment ainsi des colonnes de sel remontant des basses couches de l’écorce terrestre. Ces colonnes de sel (ou diapirs) se coiffent, près de la surface, de chapiteaux en forme de dômes. Ce sont ces “chapeaux de champignons” de sel qu’on exploite pour ce minerai dans les mines de sel. Par exemple, on trouve de tels gisements en Lorraine, en Pologne et au Texas. On les exploite par des forages, suivis de l’injection d’eau bouillante et du pompage de la saumure ainsi produite.
Pourquoi la glace des poles est-elle de l’eau douce?
L’eau de mer est une solution saline. En moyenne, sa salinité est de 35 g par litre.Lorsqu’on fait s’évaporer un tel liquide, qui est un mélange, on assiste d’abord au départ de la composante la plus volatile. En l’occurrence, c’est l’eau. Vous pouvez vous en convaincre facilement, par l’expérience suivante: goûtez un peu du givre formé sur les parois internes à votre réfrigérateur. Il n’a aucun goût salé, il est fait d’une eau en fait très pure, bien qu’il provienne des fruits, légumes et autres denrées contenues dans l’armoire frigorifique, toutes constituées de mélanges aqueux. L’évaporation a fourni un liquide pur, que le froid a condensé en cristaux sur les parois. En cas de besoin, on peut faire fondre ce givre et obtenir une eau distillée et déminéralisée, par exemple pour en alimenter la solution acide de l’accumulateur d’une voiture.De même, en montagne, la neige et la glace sont aussi de l’eau pure, une eau distillée trop pauvre en sels pour être potable telle quelle. Or les précipitations atmosphériques sur les sommets, qui les garnissent de névés, glaciers et autres neiges éternelles, viennent des nuages, c’est-à-dire de vapeur d’eau pompée par la chaleur du soleil, aux océans en majeure partie.Plus généralement, lorsqu’un mélange tel que l’eau salée s’évapore, ou cristallise, il fournit un corps pur. C’est une méthode de purification très efficace qu’on nomme, suivant le cas, distillation ou cristallisation. Ainsi, la glace de la banquise est-elle une eau très pure: elle résulte, elle, d’une cristallisation. On a d’ailleurs proposé de remorquer des icebergs, c’est-à-dire des excroissances de glaciers, pour fournir en eau potable des régions désertiques telles que le Golfe Persique; mais de tels projets restent du domaine de l’utopie.
Comment dessale-t-on l’eau de mer?
Puisque remorquer des icebergs n’est guère envisageable, pour son coût, comme pour la sécurité de la navigation, dessaler l’eau de mer est indispensable pour fournir en eau de boisson une population, confinée dans un lieu clos comme un sous-marin nucléaire, ou vivant dans une région aride, comme l’Arabie Saoudite ou la Sud Californie. L’un des procédés de dessalement les plus utilisés à présent consiste donc à chauffer l’eau de mer dans une chaudière et à la distiller. Lorsque la vapeur a été condensée, on peut recueillir une eau très pure. Pour fixer les idées, au départ d’eau de mer dont la salinité, mesurée en ppm (parties par million) est 35 000, l’eau douce de distillation ne contient plus qu’une quantité infime, entre 1 et 50 ppm seulement de sel.Une variante est le procédé de distillation à effet multiple: il tire parti de ce que la vaporisation de l’eau se fait à des températures largement inférieures à 100oC sous un vide partiel. Un autre procédé thermique de dessalement lui aussi, est la distillation éclair. Si on chauffe de l’eau à 100oC, et si on la maintient sous pression, avant de l’introduire dans une enceinte où on a fait le vide, on assiste à une transition très rapide, le liquide se transforme en un éclair en vapeur. Ces deux autres procédés thermiques, distillation à effet multiple, et distillation éclair, fournissent aussi une eau très pure (1-50 ppm de sels). Il existe d’autres procédés de dessalement.
Pourquoi le sel tue les limaces?
Saupoudrez du gros sel sur une limace: vous la retrouvez morte, dans une petite flaque d’eau salée. Cet animal est fait de cellules, dont chacune est un sac microscopique, avec une solution aqueuse à l’intérieur. Or, les parois de ces cellules, ou membranes, sont perméables. Elles laissent passer l’eau. Lorsque une membrane cellulaire sépare deux compartiments aux teneurs en sel différentes, sa perméabilité les fait communiquer: de l’eau migre de la solution la moins salée vers la solution la plus salée. Ainsi, la limace perd tant d’eau, lorsque ses cellules l’expulsent pour s’efforcer de diluer le sel environnant, qu’elle en meurt. C’est ce qui rend l’eau de mer modérément toxique à la boisson: elle cause, paradoxalement, une plus grande déshydratation encore. C’est l’un des dangers pour les rescapés d’un naufrage ; le Dr. Alain Bombard, “naufragé volontaire” prouva néanmoins la possibilité de survivre, en ne buvant que de menues quantités d’eau de mer.
Pourquoi le sel fait-il dégorger les concombres?
Pour la même raison qu’il extrait l’eau des limaces: le concombre épluché et découpé en rondelles, lorsqu’on les met au contact de sel, l’avidité de celui-ci pour l’eau (imputable à celle des cations sodium Na+ et anions chlorure Cl- qui le composent) fait se dissoudre les cristaux de sel dans l’eau issue des cellules du concombre. Le processus de dégorgement (une déshydratation donc) est accéléré au soleil et à la chaleur.Plus généralement, saler une denrée alimentaire permet d’en oter une part de l’eau qu’elle contient. Le sel a de plus un rôle désinfectant: il ne tue pas que les limaces!
Quel est le rôle du sel dans les salaisons?
La toxicité du sel n’est pas restreinte aux organismes pluricellulaires. Le sel, s’il est prodigué en abondance, tue aussi la plupart des bactéries. L’humanité en a tiré parti, depuis les temps préhistoriques, pour protéger ainsi de la corruption la viande excédentaire, qu’elle veut conserver. Le sel permet ainsi, en complément à ou à la place de la réfrigération (elle aussi très ancienne), la conservation de nombreux aliments. Encore de nos jours, on consomme couramment de telles protéines animales ainsi protégées à l’égard de la prolifération de micro-organismes toxiques: citons, entre autres, le jambon de montagne ou de Bayonne, le saucisson (l’étymologie du mot reflète d’ailleurs sa préparation), la morue salée … Le caquage, c’est-à-dire la salaison du hareng, découvert aux Pays-Bas au XIVe ou au XVe siècle, aida l’expansion du commerce maritime néerlandais; et permit les grands voyages de découverte des XVIe-XIXe siècles. De même, la salaison du poisson péché permit les pèches au long-cours des pécheurs européens, malouins entre autres, au large de Terre-Neuve, à partir du XVIIe siècle.
Pourquoi saler l’eau de cuisson des aliments?
À l’inverse du dégorgement par le sel de la limace ou du concombre, on veut éviter d’assister à un engorgement des cellules de l’aliment, animal ou végétal, placé par omission dans une eau de cuisson non salée, par l’eau faisant irruption à l’intérieur de ces cellules. Faites cuire un oeuf dur dans de l’eau douce, sa coquille éclatera, c’est probable.D’autre part, l’eau salée bout à température plus élevée que l’eau pure; le temps de cuisson est donc diminué.
Pourquoi sale-t’on une route enneigée?
L’eau salée a non seulement une température d’ébullition plus élevée, mais une température de fusion du solide (glace) plus basse. Cela vient de ce ce que, si glace et vapeur d’eau sont des corps purs, l’eau salée est un mélange, donc désordonné et ce, d’autant plus qu’on a mis davantage de sel.Ainsi, certains mélanges réfrigérants (eau + sel + glace) ont-ils des températures de fusion comprises entre – 15 et -20oC. Si vous souhaitez rafraîchir plus rapidement votre champagne, salez le contenu de votre seau à glace.C’est la même raison qui fait épandre du sel sur les routes enneigées: l’eau demeure liquide à température plus basse, et la route reste donc exempte de verglas.
Pourquoi une carence en sel donne-t’elle des crampes musculaires?
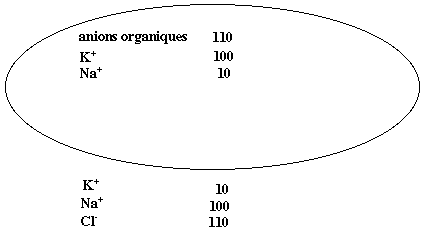
Revenons à la migration d’eau au travers des membranes des cellules, d’une solution diluée vers une solution concentrée. Elle se poursuit jusqu’à l’équilibre, lorsque les concentrations ont pu s’égaliser de part et d’autre de la membrane. La concentration est la quantité de matière (ici la quantité de sel dissous) par unité de volume.
 Figure 1: Comparaison des concentrations (en unités mM) des principaux anions et cations à l’intérieur et à l’extérieur d’une cellule-type. On note l’électroneutralité dans chacun de ces compartiments, puisque les totaux d’ions positifs et négatifs sont égaux. On note aussi l’entrée de potassium dans la cellule, et son expulsion du sodium.
Figure 1: Comparaison des concentrations (en unités mM) des principaux anions et cations à l’intérieur et à l’extérieur d’une cellule-type. On note l’électroneutralité dans chacun de ces compartiments, puisque les totaux d’ions positifs et négatifs sont égaux. On note aussi l’entrée de potassium dans la cellule, et son expulsion du sodium.
Ainsi, les cellules des organismes éjectent le sodium Na+ et font entrer le potassium K+. De ce fait, d’importantes différences de concentration existent entre l’intérieur et l’extérieur d’une cellule, d’un facteur 10 pour chacun de ces ions, comme on le voit. Outre ces différentiels de concentration, les cellules utilisent un moteur mu par l’énergie, leur venant de l’hydrolyse de l’adénosine triphosphate (ATP), pour pomper ces ions potassium et sodium, dans un rapport de trois sodium pour deux potassium. La conséquence est de doter la cellule de charges électriques négatives sur son pourtour, à l’intérieur de la membrane, et positives à l’extérieur.C’est le cas des cellules nerveuses, ou neurones: au repos, elles montrent un potentiel électrique au niveau de l’axone le tube reliant les deux extrémités d’un neurone, avec les dendrites d’un côté et les synapses de l’autre d’environ – 50 mV. Lorsque le neurone est excité, le potentiel électrique augmente très rapidement, passe par la valeur zéro, grimpe jusqu’à + 50 mV environ, puis revient à sa valeur de repos en fait, en passant par un minimum plus bas encore, d’environ – 60 mV. La montée vers le maximum, ou potentiel d’action, provient de l’irruption d’ions sodium dans l’axone; les concentrations initiales dans un rapport 10 justifient une variation de + 58 mV. Elle s’accompagne de l’expulsion d’ions potassium, ce qui explique la redescente vers un minimum, avant le retour à la position de repos. Ces entrées et sorties d’ions sont schématisées dans la Figure 2:

Figure 2: a: au repos l’axone d’un neurone est polarisé, avec des charges négatives à l’intérieur et des charges positives à l’extérieur de la membrane; de ce fait, la différence de potentiel membranaire est – 50 mV. b: l’entrée de cations sodium et la sortie de cations potassium, ou dépolarisation, font monter cette différence de potentiel à + 40 mV avant de la faire revenir à – 50 mV. c: le déplacement de cette dépolarisation le long du neurone est l’influx nerveux.
Le fonctionnement de notre système nerveux, représentatif en cela de toutes les autres cellules du corps, exige donc le maintien d’une quantité suffisante de sel. C’est la raison pour laquelle nous ingérons un à deux grammes de sel par jour. Une déficience en sel, provenant en général d’une trop grande excrétion (nous excrétons 90-95% du sel ingéré, sous forme d’urine et de sueur), se fait immédiatement sentir: en particulier par des crampes musculaires nocturnes, des mollets entre autres. C’est un signal d’alarme. Il nous rappelle que le sel est indispensable à la vie.
D’où vient le goût salé?
Chimiquement parlant, le sel est un composé; c’est du chlorure de sodium. La saveur détectée par les récepteurs du goût, sur la langue, est celle des cations sodium Na+. Le bicarbonate de sodium (ou, comme préfèrent dire les chimistes, le carbonate acide de sodium), et d’autres sels sodiques ont aussi une saveur salée.
Pourquoi l’industrie chimique a-t-elle besoin de sel?
Le sel est une importante matière première pour l’industrie chimique. Elle en tire à la fois le chlore et la soude: l’électrolyse d’une saumure, c’est-à-dire d’une solution aqueuse de sel, fournit la soude NaOH à l’une des électrodes baignant dans la solution, et le chlore Cl2 à l’autre électrode. C’est l’une des rares coproductions de la chimie lourde: en effet, il est rare que les périodes de forte demande économique en chlore et en soude coïncident. Le chlore sert, entre autres, à transformer l’éthylène en chlorure de vinyle, qui est à son tour polymérisé en polychlorure de vinyle ou PVC, qui est l’une des matières plastiques les plus utilisées, dans la construction en particulier.La soude a elle aussi de nombreuses utilisations: par exemple, elle sert à hydrolyser, c’est-à-dire à couper en fragments plus petits, les polymères naturels que sont la cellulose et la lignine des arbres pour en faire de la pâte à papier.
Pierre Laszlo
Tous droits réservés à La Recherche, 1997.